Nghiên cứu mới nhất được công bố trên Tạp chí Thực phẩm và Dinh dưỡng Hoa Kỳ, 9/2018, Tập. 6, Số 1, 9-13 Nhà xuất bản Khoa học & Giáo dục.
Nghiên cứu này được thực hiện bởi nhà sinh hóa nổi tiếng thế giới Tiến sĩ Garth Nicolson, và chuyên gia số 1 của Nhật Bản về các hiệu ứng y học của nước Hydro hoá Giáo sư Shigeo Ohta, và 8 bác sĩ cùng nhiều nhà khoa học nổi tiếng trên toàn cầu như: Steven Rosenblatt, Robert Settineri, Antonio Jimenez, Jin Ji, Gonzalo Ferrira,...
Nguồn: http://pubs.sciepub.com/ajfn/6/1/2/index.html
Sơ lược nội dung và kết quả của nghiên cứu
Nghiên cứu sử dụng: Nước Hydro "IZUMIO" đã được mua từ Naturally Plus Hoa Kỳ (NPUSA) Las Vegas, Nevada. Tại thời điểm đóng gói ban đầu, lượng Hydro trong nước thử nghiệm được phân tích bằng phép đo điện cực phân cực manometric và diaphragm ở nồng độ cuối cùng là 2,6 ppm (1,3 mM H 2 ) và pH 7,0. Nước hydro IZUMIO được sử dụng trong tất cả các xét nghiệm.
Kết quả nghiên cứu: Phân tử Hydro đã được chứng minh là có ích trong điều trị các bệnh khác nhau và như một chất chống lão hóa. Ở đây nghiên cứu đã khảo sát các ảnh hưởng của nguồn nước Hydro hoá đối với các tế bào não người được nuôi cấy. Nước Hydrogen bảo vệ được tế bào não khỏi sự mất cân bằng oxy hóa và độc tính glutamate. Nước Hydro hoá cũng tăng cường con đường tín hiệu cho phản ứng oxy hóa do trung gian của Nrf2. Những kết quả này chứng minh rằng nước hydro hoá có thể bảo vệ tế bào não chống lại các loại tổn thương tế bào thông thường do mất cân bằng bị oxy hóa và độc tính glutamate, và các trường hợp quan trọng trong Đột quỵ và các bệnh Thoái hóa thần kinh.
DƯỚI ĐÂY LÀ CHI TIẾT CỦA NGHIÊN CỨU ĐƯỢC TẠM DỊCH

"Ảnh hưởng của Nước Hydro hoá trong bảo vệ tế bào Não do mất cân bằng oxy hóa và độc tính Glutamate"
Tác giả:
Robert Settineri
Đồng tác giả: sierraprod@aol.com
Liên kết: Nghiên cứu sản xuất Sierra, Irvine, CA Hoa Kỳ
Jie Zhou
Liên kết: Brunswick Laboratories, Inc., Southborough, MA Hoa Kỳ
Jin Ji
Liên kết: PulchriBio Intl, Boston, MA Hoa Kỳ
Rita R. Ellithorpe
Liên kết: Trung tâm kéo dài tuổi thọ Tustin, Tustin, CA Hoa Kỳ
Steven Rosenblatt
Liên kết: Trung tâm Y tế Saint John, Santa Monica, CA Hoa Kỳ
Antonio Jimenez
Liên kết: Viện Hope4Cancer, Baja California, Mexico
Shigeo Ohta
Liên kết: Khoa Thần kinh, Đại học Juntendo, Trường Cao học Y khoa, Tokyo, Nhật Bản
Gonzalo Ferreira
Liên kết: Khoa Sinh, Phòng thí nghiệm Kênh Ion, Trường Y, Đại học de la Republica, Montevideo, Uruguay
Garth L. Nicolson
Liên kết: Khoa bệnh lý học Phân tử, Viện Y học Phân tử, Huntington Beach, CA Hoa Kỳ.
TÓM TẮT NỘI DUNG:
Nước hydro hóa được biết là có tác dụng bảo vệ các tế bào và mô, chủ yếu thông qua các hoạt động chống oxy hóa của nó. Ở đây chúng tôi đã kiểm tra tác động bảo vệ của một nguồn nước hydro hóa thương mại trên các tế bào não người được nuôi cấy. Nước hydro hóa có thể bảo vệ các tế bào não khỏi stress oxy hóa và độc tính glutamate. Ở nồng độ H2 trên 0,01 mM, nồng độ glutathione tăng lên trong các tế bào não nuôi cấy. Mức độ glutathione tăng từ khoảng 500 đến xấp xỉ 850 μM ở liều nước hydro hóa tối đa với EC50 khoảng 0,030 mM. Nước hydro hóa cũng có thể tăng cường đường dẫn tín hiệu cho phản ứng căng thẳng oxy hóa qua trung gian Nrf2 (yếu tố giống như hạt nhân erythroid 2). Xử lý tế bào bằng nước hydro hóa ở nồng độ trên 0,01 mM H2 do kích hoạt Nrf2 (EC50 khoảng 0,05 mM). Nước hydro hóa cũng có thể bảo vệ các tế bào não chống lại độc tính của glutamate. Sử dụng yếu tố phản ứng phá hủy DNA, (γH2AX, để theo dõi thiệt hại của độc tính glutamate, chúng tôi thấy rằng nồng độ H2 trên 0,01 mM được bảo vệ khỏi thiệt hại glutamate với EC50 khoảng 0,05 mM H2. Kết quả in vitro đã chứng minh rằng nước hydro hóa có thể bảo vệ tế bào não chống lại các loại thiệt hại phổ biến từ stress oxy hóa và độc tính glutamate.
- Giới thiệu
Các tế bào trong hệ thần kinh trung ương (CNS) là một trong những tế bào hoạt động trao đổi chất nhiều nhất trong cơ thể chúng ta, và chúng cũng thuộc nhóm nhạy cảm nhất với stress oxy hóa 1, 2, 3. Stress oxy hóa xảy ra khi có quá nhiều oxy và nitơ phản ứng các loài (ROS, RNS) so với các phân tử chống oxy hóa tự nhiên và thêm 3, 4, 5, 6, 7. Trong các trường hợp bình thường, các chất oxy hóa phản ứng, ROS và RNS, được tạo ra với số lượng thấp trong đó chúng có thể đóng vai trò là các phân tử tín hiệu quan trọng trong các sự kiện tế bào chất, như tín hiệu yếu tố tăng trưởng, autophagy ty thể và phân chia tế bào hạt nhân. ROS và RNS cũng rất quan trọng trong chức năng miễn dịch, viêm và các phản ứng tế bào và mô quan trọng khác 3, 4, 5, 6, 7.
Căng thẳng oxy hóa quá mức trong não có liên quan và góp phần vào nguyên nhân hoặc tiến triển của các bệnh thoái hóa thần kinh. Điều này là do lượng oxy sử dụng không cân xứng trong mô này và cơ hội sản xuất quá mức ROS / RNS có thể làm hỏng lipit tế bào não, protein và axit nucleic 7, 8, 9. Một trong những hệ thống trung hòa stress oxy hóa dư thừa do đối với ROS / RNS là hệ thống glutathione 10. Glutathione là một thiol phổ biến có tác dụng phối hợp với các chất chống oxy hóa khác để làm giảm ROS / RNS và ngăn ngừa tổn thương cho các tế bào não 9, 10, 11, 12. Nó cũng là một phân tử chuyển cho cysteine và có liên quan đến việc giữ protein sulfhydryl ở trạng thái giảm, điều này rất quan trọng trong việc duy trì tiềm năng oxy hóa tế bào cũng như giải độc 10, 12, 13.
Một hệ thống phòng thủ tế bào khác chống lại stress oxy hóa trong não được trung gian bởi yếu tố hạt nhân erythroid 2 (Nrf2) 14, 15. Nrf2 là thành viên của họ cap'n'collar của các yếu tố phiên mã dây kéo leucine trong nhân dị hợp với các protein nhỏ (protein MAF, JUN) và liên kết với các vị trí DNA có chứa các yếu tố phản ứng chống oxy hóa (IS) và các vị trí khác để bắt đầu phiên mã các gen tế bào chất 16. Hệ thống Nrf2 cũng được liên kết để kích hoạt tác dụng chống viêm của NFB 17, 18. Kích hoạt Nrf2 không đủ ở người có liên quan đến các bệnh thoái hóa thần kinh, như bệnh Parkinson, bệnh Alzheimer và Bệnh xơ cứng cột sống bên 17, 19.
Ngoài căng thẳng oxy hóa, có một số dấu hiệu cho độc tính trong não, nhưng một trong những nghiên cứu rộng rãi nhất là chất dẫn truyền thần kinh L-glutamate. L-glutamate là một chất dẫn truyền thần kinh kích thích chủ yếu trong não, và nó tham gia vào hầu như tất cả các hoạt động của hệ thần kinh 20, 21. L-glutamate liên kết và kích hoạt cả hai kênh ion ligand-gated (thụ thể glutamate ion) Các thụ thể kết hợp protein G (thụ thể glutamate metabotropic). Nồng độ glutamate nội bào trong não thường ở mức millimole; tuy nhiên, nồng độ glutamate ngoại bào được giữ ở mức thấp (trong phạm vi micromol thấp) bởi các chất vận chuyển axit amin kích thích nhập phân tử này vào tế bào hình sao và tế bào thần kinh. Khi thừa glutamate ngoại bào, điều này có thể dẫn đến độc tính kích thích như đã thấy trong đột quỵ thiếu máu cục bộ và các bệnh thoái hóa thần kinh 20, 21.
Nước hydro hóa đã được chứng minh là hoạt động như một chất chống oxy hóa tế bào và điều hòa gen 22, 23. Trước đây chúng tôi thấy rằng nước hydro hóa là một chất chống oxy hóa tế bào hiệu quả và có thể làm giảm sự vận chuyển glucose theo cách phụ thuộc vào liều lượng và thời gian và làm tăng mức độ phosphoryl hóa của Akt, một dấu ấn sinh học protein kinase B để truyền tín hiệu insulin 24. Chúng tôi cũng thấy rằng nước hydro hóa có thể làm tăng mức độ biểu hiện gen SIRT1 liên quan đến tuổi và tăng biểu hiện hoạt động của telomerase trong quá trình phụ thuộc vào liều 24. Ở đây chúng tôi đã kiểm tra khả năng nước hydro hóa trong ống nghiệm để bảo vệ các tế bào não khỏi tổn thương oxy hóa bằng cách tăng mức độ glutathione và giảm độc tính của glutamate. Chúng tôi cũng kiểm tra khả năng của nước hydro hóa để kích hoạt con đường Nrf2 như là một dấu hiệu cho các hoạt động chống oxy hóa và chống viêm.
- Vật liệu và phương pháp
Nước hydro hóa được xác định là nước Hydrogen IZUMIO được mua từ Naturally Plus USA (NPUSA) Las Vegas, Nevada. Tại thời điểm đóng gói ban đầu, hydro được truyền trong nước thử nghiệm được phân tích bằng cả phép đo điện cực phân cực đo áp suất và màng ngăn ở nồng độ cuối cùng là 2,6 ppm (1,3 mM H2) và pH 7,0. Nước hydro hóa IZUMIO được sử dụng trong tất cả các xét nghiệm 24.
Dòng tế bào thần kinh SH-SY5Y của người và dòng tế bào HepG2 được lấy từ Bộ sưu tập Văn hóa Kiểu Mỹ (ATCC, Manassas, VA, USA). Môi trường Eagle đã được sửa đổi của Dulbecco (DMEM), Phương tiện tối thiểu cần thiết của Eagle (EMEM) và Phương tiện F12 được mua từ GIBCO ™ (Grand Island, NY, Hoa Kỳ). Huyết thanh bò bào thai (FBS), Phương tiện tối thiểu cần thiết (MEM) và Dung dịch muối cân bằng Earle được mua từ Hyclone (Pittsburg, PA, Hoa Kỳ). Natri pyruvate, penicillin, streptomycin, quercetin, dung dịch formaldehyd, Triton X-100 và nước nuôi cấy tế bào được lấy từ Sigma (St. Louis, MO, Hoa Kỳ). Nước muối đệm phốt phát của Dulbecco (DPBS), Monochlorobimane, Hoechst 33342 (nhuộm DNA), cocktail kháng thể chính bao gồm chuột kháng phospho-histone H2A.X và Hoechst 333342 và kháng thể thứ cấp Cy3-lừa từ Thermo Fisher Khoa học (Fremont, CA, Hoa Kỳ). Thuốc thử được sử dụng trong xét nghiệm luciferase Nrf2 được mua từ Promega. Các tấm di động được mua từ Tập đoàn Corning Costar (Cambridge, MA, USA).
2.1. Xét nghiệm độc tính Glutamate
Tác dụng của nước hydro hóa trong bảo vệ tế bào não đã được nghiên cứu bằng cách sử dụng độc tính của glutamate như là dấu ấn sinh học tế bào 25. Tế bào u nguyên bào thần kinh ở người được nuôi cấy trong hỗn hợp 1: 1 của Eagle Medium Medium Medium và F12 Medium với huyết thanh bào thai ở nồng độ cuối cùng 10% và được gieo vào đĩa nuôi cấy tế bào 24 giếng và nuôi cấy trong 24 giờ trước khi bổ sung các mẫu thử trong môi trường nuôi cấy tế bào. Trong các tình huống xử lý nước hydro hóa, môi trường nuôi cấy như bột khô đã bị đình chỉ và hòa tan trong nước hydro hóa mới mở. Nồng độ cuối cùng khác nhau của nước hydro hóa trong nước nuôi cấy tế bào được sử dụng hoặc theo tỷ lệ v / v là 1, 0,5, 0,25, 0,125, 0,062 và 0,03125 nước hydro hóa cho nước nuôi cấy tế bào). Sau khi chuẩn bị, môi trường nuôi cấy được lọc vô trùng và được sử dụng để điều trị các tế bào thần kinh ngay lập tức. Tất cả các thí nghiệm đã được thực hiện trong ba lần.
Các tế bào SH-SY5Y được tiếp xúc với môi trường nuôi cấy bình thường hoặc môi trường nuôi cấy được tạo ra với nồng độ nước hydro hóa khác nhau trong 24 giờ, và sau đó được thử thách với 250 amM glutamate trong 24 giờ. Sau khi rửa hai lần với môi trường nuôi cấy, các tế bào được cố định bằng dung dịch formaldehyd 3,7% trong 30 phút. Các tế bào cố định sau đó được rửa bằng DPBS hai lần trên máy giặt tấm Biotek và sau đó được xử lý bằng dung dịch thấm được bao gồm 0,5% (v / v) Triton X-100 trong 10 phút. Sau 10 phút điều trị, các tế bào được rửa bằng DPBS một lần và bị chặn trong 30 phút bằng dung dịch chặn (albumin huyết thanh bò 1% trong DPBS) trước khi nhuộm kháng thể. Sau khi ủ trong dung dịch ngăn chặn, các tế bào được rửa lại bằng DPBS một lần và được ủ với một loại cocktail kháng thể chính bao gồm chuột chống phospho-histone H2A.X và Hoechst 333342 ở nhiệt độ phòng trong 1 giờ. Sau khi rửa hai lần với DPBS trên máy giặt tấm Biotek, kháng thể thứ cấp (Cy3-donkey-anti-rabbit-IgG) được phân phối vào từng giếng và được tiếp tục ở nhiệt độ phòng trong một giờ nữa. Sau khi rửa hai lần với DPBS trên máy giặt tấm Biotek, 200 DPL DPBS được để lại trong mỗi giếng. Sau đó, tấm được niêm phong và đọc trên ArrayScan VTi bằng cách sử dụng Ứng dụng phân tích sinh học phân tích. Dữ liệu được xử lý và báo cáo với hệ thống LIM. Các đường cong ức chế và EC50 được tạo ra thông qua Lăng kính Graphpad.
2.2. Xét nghiệm cấp độ Glutathione (GSH)
Tác dụng của nước hydro đối với việc bảo vệ tế bào não đã được nghiên cứu bằng cách sử dụng mức glutathione nội bào như là dấu ấn sinh học tế bào 26. Tế bào u nguyên bào thần kinh người SH-SY5Y được nuôi cấy trong hỗn hợp 1: 1 của Eagle Medium Medium Medium và F12 Medium với huyết thanh bào thai. nồng độ cuối cùng là 10%, được gieo vào đĩa nuôi cấy tế bào 96 giếng và nuôi cấy trong 24 giờ trước khi bổ sung hợp chất thử trong môi trường nuôi cấy tế bào. Khi môi trường chứa nước hydro hóa được sử dụng, bột khô môi trường nuôi cấy đã bị đình chỉ và hòa tan trong nước hydro hóa mới mở và nồng độ cuối cùng của nước hydro hóa trong nước nuôi cấy tế bào được sử dụng ở v / v 1,00, 0,50, 0,250, 0,0125, 0,00625 và 0,003125 nước hydro hóa thành nước nuôi cấy tế bào, như trước đây được sử dụng cho các loại tế bào khác 24. Môi trường nuôi cấy sau đó được lọc vô trùng và được sử dụng để xử lý tế bào thần kinh ngay lập tức. Tất cả các thí nghiệm đã được thực hiện trong ba lần.
Để kiểm tra phản ứng với các tế bào căng thẳng oxy hóa đã được xử lý bằng môi trường nước hydro hóa trong 24 giờ và sau đó tiếp xúc với H 2 O 2 (300 M) trong 2 giờ. Các tế bào sau đó được ủ trong kiểm soát hoặc thử nghiệm môi trường nước hydro hóa ở nồng độ nêu trên trong 24 giờ. Sau khi rửa hai lần bằng môi trường nuôi cấy, các tế bào trong mỗi giếng được ủ bằng Monochlorobimane (nồng độ cuối cùng là 50 μM) trộn với 30 μl 10 mg / ml Hoechst 33342 trong 15 phút ở 37 ° C. Sau khi rửa hai lần với PBS, các tấm được đọc trên VTI mảng có thể sử dụng 2 kênh và có được giao thức 10X cho một trường. Dữ liệu được xử lý và báo cáo với hệ thống LIM. Các đường cong ức chế và EC50 được tạo ra thông qua Lăng kính Graphpad.
2.3. Xét nghiệm kích hoạt tế bào Nrf2
Tác dụng của nước hydro trên con đường Nrf2 của tế bào cũng được nghiên cứu. Canada bầu không khí 5% CO2 95% không khí ở 37 ° C. Các tế bào sau đó được gieo hạt với mật độ 35.000 tế bào mỗi giếng vào một đĩa 96 giếng đáy rõ ràng chứa 100 μl môi trường tăng trưởng (MEM / EBSS (Hyclone), 10% FBS, 1% axit amin không thiết yếu, 1 mM Na-pyruvate và 1% Pen / Strep, sau đó được ủ qua đêm ở 37 ° C trong lò ấp CO2. Phóng viên đã được truyền vào các tế bào vào ngày hôm sau và được ủ qua đêm ở 37 ° C trong lò ấp CO2. Trong môi trường thử nghiệm hoặc môi trường kiểm soát vào ngày hôm sau. Trong các tình huống sử dụng nước hydro hóa trong môi trường nuôi cấy, bột khô vừa được nuôi cấy và hòa tan trong nước hydro hóa mới mở ở nồng độ khác nhau của nước hydro hóa trong nước nuôi cấy tế bào ở v / v 1,00, 0,50, 0,250, 0,0125, 0,00625 và 0,003125 nước được hydro hóa thành nước nuôi cấy tế bào. Môi trường nuôi cấy được lọc vô trùng và sử dụng để xử lý tế bào ngay lập tức. Sau khi ủ trong 18 giờ, các tế bào được lọc với tế bào 20μL đệm ly giải văn hóa như trước đây và được ủ với chất nền xét nghiệm luciferase 100μL. Độ phát quang được đo bằng đầu đọc đĩa đa chế độ
2.4. Phân tích thống kê
Do kích thước mẫu nhỏ, một thử nghiệm không tham số đã được sử dụng, thử nghiệm Kruskal-Wallis. Thử nghiệm Kruskal - Wallis là phương pháp thay thế không tham số cho ANOVA một chiều và không giả định tính quy phạm của phần dư. Giả thuyết khống của bài kiểm tra này là tất cả các trung vị đều bằng nhau. Nếu xét nghiệm Kruskal-Wallis có ý nghĩa, nó chỉ ra rằng ít nhất hai nồng độ có trung bình khác nhau đáng kể. Phân tích thống kê được thực hiện bằng JMP®, phiên bản 13 (SAS Institute, Inc., Cary, NC) bởi Đơn vị tư vấn thống kê của Đại học Cornell, Ithaca, NY 28.
- Kết quả và thảo luận
3.1. Độc tính của Glutamate
Glutamate là một chất dẫn truyền thần kinh kích thích chủ yếu trong hệ thống thần kinh trung ương có liên quan đến các chức năng của não bao gồm nhận thức, trí nhớ và học tập 29. Nó nói lên mạng lưới tín hiệu điều chỉnh sự phát triển của não, sự khác biệt và hoạt động của các khớp thần kinh 30. Trong khi đó, một liều glutamate tối ưu là rất cần thiết. đối với sinh lý não bình thường, liều thấp và cao có thể kích hoạt các dòng độc thần kinh hoặc kích thích độc tố 31. Glutamate được trung gian chủ yếu thông qua hai loại thụ thể glutamate ionotropin, thụ thể NMDA và thụ thể không phải NMDA 32.
Trong thí nghiệm này, chúng tôi đã theo dõi phản ứng phá hủy DNA (γH2AX) để đánh giá hiệu quả của vật liệu thử nghiệm (nước hydro hóa) trong việc bảo vệ các tế bào não của con người khỏi độc tính của glutamate. Chúng tôi đã xử lý các tế bào u nguyên bào thần kinh SH-SY5Y ở người trong 24 giờ với một loạt nồng độ nước hydro hóa trong môi trường nuôi cấy. Trên nồng độ H2 0,01 mM H2, hàm lượng tế bào của γH2AX đã giảm. Kết quả chỉ ra rằng γH2AX đã giảm 50% khi các tế bào được xử lý với nồng độ bằng 52,8% (0,030 mM H2) nước hydro hóa (có ý nghĩa trong xét nghiệm Kruskal-Wallis, χ = 13,21, p = 0,0215) (Hình 1) . Những kết quả này chỉ ra rằng nước hydro hóa có thể góp phần phục hồi tổn thương DNA do độc tính của glutamate trong tế bào não.

Hình 1. Ảnh hưởng của nước hydro hóa đến độc tính của glutamate được theo dõi bởi phản ứng phá hủy DNA (γH2AX). Các tế bào u nguyên bào thần kinh SH-SY5Y ở người được điều trị bằng một loạt môi trường nuôi cấy chứa nồng độ nước hydro hóa khác nhau trong 24 giờ trước khi tiếp xúc với glutamate. Tác dụng bảo vệ của hydro chống độc tính của glutamate được xác định bằng cách giảm H2AX như được mô tả trong Vật liệu và Phương pháp. Trong sơ đồ này, lượng tương đối của γH2AX (so với đối chứng không được xử lý) so với nồng độ hydro, EC50 được tính là 0,030 mM H2
Khi có quá nhiều glutamate ngoại bào, nó có thể kích hoạt độc tính kích thích in vitro và in vivo trong các tình huống cấp tính như đột quỵ do thiếu máu cục bộ thông qua kích hoạt quá mức các thụ thể glutamate ionotropic. Ngoài ra, độc tính kích thích mãn tính đã được tìm thấy có vai trò trong một số bệnh thoái hóa thần kinh, bao gồm xơ cứng teo cơ bên, bệnh Alzheimer và bệnh Huntington Nott 33. Vì vậy, việc duy trì mức độ glutamate ngoại bào thích hợp là rất cần thiết để ngăn ngừa nhiễm độc thần kinh trung ương.
3.2. Glutathione (GSH)
Glutathione (GSH) là một chất chống oxy hóa thiol tripeptide nội bào quan trọng giúp bảo vệ các tế bào khỏi tổn thương gốc tự do bằng cách giảm tương đương để giảm lipid hydroperoxide 9. Sự suy giảm GSH có liên quan đến sinh bệnh học của bệnh thần kinh, đặc biệt là bệnh Parkinson (PD). , 35. Trong thử nghiệm này, chúng tôi đã đánh giá hiệu quả của nước hydro hóa trong việc tăng nồng độ GSH trong các tế bào não như là một dấu hiệu cho mức độ chống oxy hóa trong các tế bào thần kinh 36. Điều này được thực hiện bằng cách xử lý các tế bào SH-SY5Y của tế bào thần kinh ở người trong 24 giờ với một loạt nồng độ của nước hydro hóa, sau đó làm cho các tế bào bị stress oxy hóa và đo lường tác động của nước hydro hóa lên mức GSH. Kết quả chỉ ra rằng nồng độ GSH tăng ở nồng độ H2 trên 0,01 mM H2 hoặc 50% khi các tế bào được xử lý bằng 35% (0,0196 mM H2) nước hydro hóa (sự khác biệt đáng kể trong xét nghiệm Kruskal-Wallis, χ = 14,38, p = 0,0134 ) (Hình 2). Điều này chỉ ra rằng nước hydro hóa có thể góp phần phục hồi nồng độ GSH trong quá trình oxy hóa trong các tế bào não.
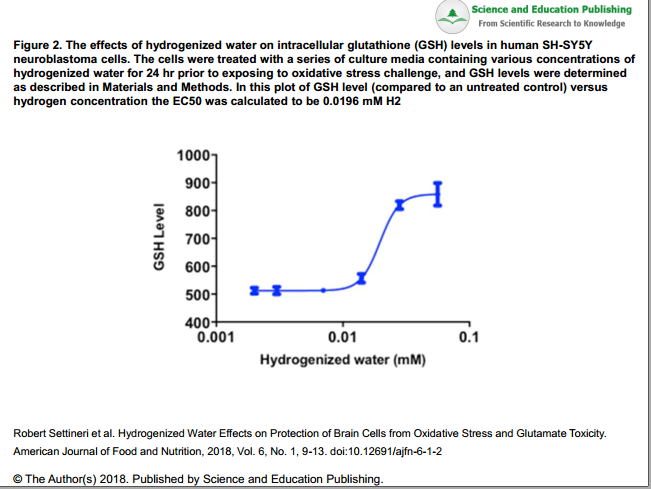
Hình 2. Ảnh hưởng của nước hydro hóa đến mức glutathione nội bào (GSH) trong tế bào u nguyên bào thần kinh SH-SY5Y ở người. Các tế bào được xử lý bằng một loạt môi trường nuôi cấy chứa nồng độ nước hydro hóa khác nhau trong 24 giờ trước khi tiếp xúc với thách thức stress oxy hóa và nồng độ GSH được xác định như mô tả trong Vật liệu và Phương pháp. Trong biểu đồ mức độ GSH này (so với đối chứng không được điều trị) so với nồng độ hydro, EC50 được tính là 0,0196 mM H2
GSH tham gia vào nhiều chức năng của tế bào và do đó, nó là một phân tử tế bào quan trọng 35, 36. Mức độ GSH có liên quan đến sự phá hủy oxy hóa tăng và được biết là giảm dần theo tuổi tăng và trong một số tình trạng bệnh nhất định 37, 38. Do đó, mức độ GSH bảo vệ các tế bào từ thiệt hại oxy hóa cũng như thiệt hại do hóa chất độc hại 38, 39.
3.3. Kích hoạt tế bào Nrf2
Yếu tố hạt nhân erythroid 2 liên quan đến yếu tố 2 (Nrf2) là yếu tố phiên mã nhạy cảm với oxi hóa liên kết với các yếu tố phản ứng chống oxy hóa (IS) để điều chỉnh sự biểu hiện của các enzyme chống oxy hóa bảo vệ chống lại tổn thương oxy hóa gây ra bởi chấn thương và viêm 40. Kích hoạt Nrf2 Con đường đã được tìm thấy để ngăn ngừa và đã được sử dụng để điều trị một số lượng lớn các bệnh viêm mãn tính 41. Một số chất phytonutrients tự nhiên, như resveratrol, sulforaphane, và curcumin đã được báo cáo để kích hoạt Nrf2, với chất kích hoạt Nrf2 bổ sung. trọng tâm của các nghiên cứu mới 42. Nrf2 cũng đã được nghiên cứu như một dấu ấn sinh học để điều chỉnh các phản ứng chống oxy hóa và chống viêm in vivo 43.
Trong thí nghiệm này, chúng tôi đã xử lý các tế bào người có hoặc không có nước hydro hóa, và tác động của nước hydro hóa lên hoạt hóa Nrf2 đã được xác định. Khi nước hydro hóa được thêm vào môi trường nuôi cấy ở nồng độ trên 0,01 mM H2, phản ứng kích hoạt Nrf2 đã tăng lên. Chúng tôi thấy rằng mức độ kích hoạt Nrf2 tăng 50% khi các tế bào được xử lý với khoảng 0,05 mM H2 (ý nghĩa trong thử nghiệm Kruskal-Wallis, χ = 11,99, p = 0,035) (Hình 3).

Hình 3. Ảnh hưởng của nước hydro hóa đến việc kích hoạt yếu tố phiên mã Nrf2 trong tế bào HepG2 của con người. Các tế bào được xử lý bằng một loạt môi trường nuôi cấy chứa nồng độ nước hydro hóa khác nhau trong đêm và mức độ kích hoạt Nrf2 được xác định như mô tả trong Vật liệu và Phương pháp. Trong sơ đồ mức độ kích hoạt Nrf2 tương đối này (so với đối chứng không được điều trị) so với nồng độ hydro, EC50 được tính là 0,097 mM H2
Nrf2 được coi là yếu tố điều hòa hạt nhân đa chức năng 14, 16, 40, 41. Như đã mô tả ở trên, nó đóng vai trò quan trọng như là yếu tố bảo vệ tế bào điều hòa sự biểu hiện của các gen liên quan đến protein chống oxy hóa, chống viêm và giải độc, và nó là cũng được coi là một bộ điều biến quan trọng của tuổi thọ loài 44, 45. Nó có liên quan đến sinh bệnh học của một số rối loạn phụ thuộc vào tuổi, bao gồm các bệnh thoái hóa thần kinh. Do đó, các chất như nước hydro hóa có tác dụng làm tăng Nrf2 có thể đóng vai trò chống căng thẳng và chống lão hóa và nên được coi là các phân tử bảo vệ chống lại tổn thương tế bào và lão hóa 45.
- Kết luận
Hydro phân tử đã được chứng minh là hữu ích trong điều trị các tình trạng y tế khác nhau và như là một chất bổ sung chống lão hóa 22, 23. Ở đây chúng tôi đã kiểm tra tác động của một nguồn nước hydro hóa đối với các tế bào não nuôi cấy. Nước hydro hóa bảo vệ các tế bào não khỏi stress oxy hóa và độc tính glutamate. Nước hydro hóa cũng tăng cường đường dẫn tín hiệu cho phản ứng căng thẳng oxy hóa qua trung gian Nrf2. Những kết quả này đã chứng minh rằng nước hydro hóa có thể bảo vệ các tế bào não chống lại các loại tổn thương tế bào thông thường do stress oxy hóa và độc tính glutamate, các sự kiện quan trọng trong đột quỵ và các bệnh thoái hóa thần kinh.
Lời cảm ơn
Công việc nghiên cứu này được hỗ trợ bởi Naturally Plus Hoa Kỳ
Tài liệu tham khảo
[1] Beal MF. Ty thể chiếm giai đoạn trung tâm trong quá trình lão hóa và thoái hóa thần kinh. Ann Neurol. 2005; 58: 495-505.
[2] Dias V, Junn E, Mouradian MM. Vai trò của stress oxy hóa trong bệnh Parkinson. J Parkinsons Dis. 2013; 3 (4): 461-491.
[3] Schiavone S, Jaquet V, Trabace L, Krause K-H. Căng thẳng cuộc sống nghiêm trọng và căng thẳng oxy hóa trong não: từ mô hình động vật đến bệnh lý của con người. Tín hiệu oxy hóa khử oxy hóa. 2013; 18 (12): 1475-1490.
[4] Finkel T. Truyền tín hiệu bởi các loài oxy phản ứng. Biol tế bào J. 2011; 125: 376-393.
[5] Janssen-Heininger YM, Mossman BT, Heintz NH, Forman HJ, Kalyanaraman B, et al. Quy định dựa trên oxi hóa khử của tín hiệu: nguyên tắc, cạm bẫy và hứa hẹn. Medol Biol miễn phí. 2008; 45: 1-17.
[6] Navarro-Yepes J, Burns M, Anandhan A, Khalimonchuk O, Maria del Razo L, Quintanilla-Vega B, Pappa A, Panayiotidis MI, Franco R. Oxidative, báo hiệu oxy hóa và khử oxy. Tín hiệu oxy hóa khử oxy hóa. 2014; 21 (1): 66-85.
[7] Fischer R, Maier O. Liên quan đến stress oxy hóa và viêm trong các bệnh thoái hóa thần kinh: vai trò của TNF. Oxid Med Cell Longev. 2015; 2015: 610813.
[8] Di Meo S, Sậy TT, Venditti P, Victor VM. Vai trò của nguồn ROS và RNS trong điều kiện sinh lý và bệnh lý. Oxid Med Cell Longev. 2016; 2016: 1245049.
[9] Smeyne M, Smeyne RJ. Chuyển hóa Glutathione và bệnh Parkinson. Biol Med gốc tự do. 2013; 62: 13-25.
[10] Meister A, Anderson ME. Glutathione. Annu Rev Biochem. 1983; 52: 711-760.
[11] Aoyama K, Nakaki T. Tổng hợp glutathione bị suy giảm trong thoái hóa thần kinh. Int J Mol Sci. 2013; 14: 21021-21044.
[12] Johnson WM, Wilson-Deflosse AL, Mieyal JJ. Rối loạn nội cân bằng glutathione trong các bệnh thoái hóa thần kinh. Chất dinh dưỡng. 2012; 4: 1399-1440.
[ 13 ] Chính PAE, Angley MT, O'Doherty CE, Thomas P, Fenech m. Vai trò tiềm năng của chất chống oxi hoá và giải độc đặc tính của glutathione trong rối loạn phổ tự kỷ : đánh giá thuộc hệ thống và phân tích tổng hợp. Nutr Metab. ( Lond ) 2012 ; 9 : 36.
[14] Ma Q. Vai trò của Nrf2 trong stress oxy hóa và độc tính. Annu Rev Pharmacol Toxicol. 2013; 53: 301-426.
[15] Huang Y, Li W, Su Z-Y, Kong A-NT. Sự phức tạp chuỗi phản ứng hóa sinh Nrf2: vượt ra ngoài phản ứng chống oxy hóa. J Nutr Biochem. 2015; 26: 1401-1413.
[16] Tebay LE, Robertson H, Durant ST, Vitale SR, Penning TM, Dinkova-Kostova AT, Hayes JD. Các cơ chế kích hoạt yếu tố phiên mã Nrf2 bằng tác nhân oxy hóa khử, tín hiệu dinh dưỡng và trạng thái năng lượng và các con đường qua đó làm suy giảm bệnh thoái hóa. Biol Med Gốc tự do. 2015; 88: 108-146.
[17] Sandberg M, Patil J, D hèAngelo B, Weber SG, Mallard C. Nrf2-quy định về sức khỏe não bộ và bệnh tật: liên quan đến viêm não. Neuropharmacol. 2014; 79: 298-306.
[18] Huang Y, Li W, Su Z-Y, Kong A-N T. Sự phức tạp của chuỗi phản ứng hóa sinh Nrf2: vượt ra ngoài phản ứng chất chống oxy hóa. J Nur Biochem. 2105; 26: 1401-1413.
[19] Ramsey CP, Glass CA, Montgomery MB, Lindl KA, Ritson GP, Chia LA, et al. Biểu hiện của Nrf2 trong các bệnh thoái hóa thần kinh. J Neuropathol Exp Neurol. 2007: 66: 75-85.
[20] Marmiroli P, Cavaletti G. Sự dẫn truyền thần kinh glutamatertic trong hệ thống thần kinh trung ương. Curr Med Chem. 2012; 19: 1269-1276.
[21] Chu Y, Danbolt NC. Glutamate như một chất dẫn truyền thần kinh trong não khỏe mạnh. J Thần kinh Transm. 2014; 121: 799-817.
[22] Ohta S. Phân tử hydro như một chất chống oxy hóa mới. Tổng quan về những lợi thế của hydro cho các ứng dụng y tế. Meth Enzymol. 2015; 555: 289-317.
[23] Nicolson GL, Ferreira de Mattos G, Settineri R, Costa C, Ellithorpe R, Rosenblatt S, La Valle J, Jimenez A, Ohta S. Tác dụng lâm sàng của việc sử dụng hydro: từ bệnh động vật và các bệnh ở người đến y học thể thao. Intern J Clinic Med. 2016: 7: 32-76.
[24] Settineri R, Ji J, Luo C, Ellithorpe RR, Ferreira de Mattos G, Rosenblatt S, La Valle J, Jinenez A, Ohta S, Nicolson GL. Tác dụng của nước hydro hóa trong dấu ấn sinh học nội bào đối với chất chống oxy hóa, hấp thu glucose, tín hiệu insulin và hoạt động SIRT1 và telomerase. Am J Thực phẩm dinh dưỡng. 2016; 4: 161-168.
[ 25 ] Navjot S, Singh R, Sarangi U, N Saxena, Chaudhary, G Kaur, Kaul SC, Wadhwa R. Sự kết hợp của tinh chất lá Rễ sâm Ấn độ Ashwagandha - các tế bào não có nguồn gốc từ lprotect chống lại sức oxi hoá và gây ra sự phân hoá. PLoS ONE. 2015; 10: e0120554.
[26] Barayuga SM, Pang X, Andres MA, Panee A, Bellinger FP. Methamphetamine làm giảm mức độ Glutathione Peroxidase 1 và 4 trong các tế bào thần kinh SH-SY5Y: Tác dụng bảo vệ của Selenium. Độc tố thần kinh. 2013; 37: 240-246.
[27] Lee J-M, Chan K, Kan YW, Johnson JA. Sự gián đoạn mục tiêu của Nrf2 gây ra thiếu máu tán huyết qua trung gian miễn dịch tái tạo. Proc Natl Acad Sci Hoa Kỳ. 2004; 101: 9751-9756.
[28] R Nhóm cốtlõi. Ngôn ngữ và môi trường cho thống kê tính toán. Nền tảng R cho thống kê tính toán, Vienna, Áo, 2017. https://www.R-project.org.
[ 29 ] Zhou Y, Danbolt NC. Glutamate như chất dẫn truyền thần kinh trong não khỏe mạnh. Transm Thuộc dây thần kinh j. 2014 ; 121 : 799-817.
[30] Mayford M, Siegelbaum SA, Kandel ER. Sự tiếp hợp và lưu trữ trí nhớ. Cold Spring Har Perspect Biol. 2012; 4: a005751.
[31] Ikonomidou C, Turski L. Tại sao thuốc đối kháng thụ thể NMDA thất bại trong các thử nghiệm lâm sàng cho đột quỵ và chấn thương sọ não? Lancet Neurol. 2002; 1: 383-386.
[32] Khaynelis SF, Wollmuth LP, McBain CJ, Menniti FS, Vance KM, Ogden KK, et al. Các kênh ion thụ thể glutamate: cấu trúc, điều chỉnh và chức năng. Dược điển Rev 2010; 62: 405-496.
[33] Lewerenz J, Maher P. Độc tính glutamate mãn tính trong các bệnh thoái hóa thần kinh - Bằng chứng là gì? Front Neurosci. 2015; 9: 469.
[34] Pearce RK, Owen A, Daniel S, Jenner P, CD Marsden. Thay đổi trong việc phân phối glutathione trong vùng chất xám trong bệnh Parkinson. J Neural Transm. 1997; 104: 661-667.
[35] Mischley LK, Conley KE, Shankland EG, Kavanagy TJ, Rosenfeld ME, Duda JE, CC trắng, Wilbur TK, De La Torre P, Padowski JM. Hệ thống thần kinh trung ương hấp thu glutathione nội sọ trong bệnh Parkinson. NPJ Parkinson Dis. 2016; 2: 16002.
[36] Sies H, Berndt C, Jones DP. Oxidative Stress. Annu Rev Biochem. 2017; 86: 715-748.
[37] Liu Y, Hyde AS, Simpson MA, Barycki JJ. Các mô hình điều tiết mới nổi trong chuyển hóa glutathione. Adv Cancer Res. 2014; 122: 69-101.
[38] Currais A, Maher P. Hậu quả chức năng của những thay đổi phụ thuộc vào tuổi trong tình trạng glutathione trong não. Tín hiệu oxy hóa khử oxy hóa. 2013; 19: 813-822.
39] TTHERnd DM, Tew KD. Vai trò của glutathione-S-transferase trong kháng thuốc chống ung thư. Oncogene 2003; 22: 7369-7375.
40] Suryakant KN, Khatri R, Jaiswal AK. Điều chỉnh của Nrf2 - cập nhật. Medol Biol gốc tự do 2014; 66.
[41] Gao B, Doan A, Hybertson BM. Tiềm năng lâm sàng ảnh hưởng đến tín hiệu Nrf2 trong các rối loạn thoái hóa và miễn dịch. Dược lâm sàng. 2014; 6: 19-39.
[42] Su Z-Y, Shu L, Khor TO, Lee JH, Fuentes F, Kong A-N T. Quan điểm về hóa chất có nguồn gốc từ thực vật và ngăn ngừa ung thư: stress oxy hóa, Nrf2 và di truyền học biểu sinh. Top Curr Chem. 2013; 329: 133-162.
[43] Ma Q, He X. Cơ sở phân tử có khuynh hướng nhận electron và oxy hoá: những dự báo và hiểm họa của Nrf2. Dược điển Rev. 2012; 64: 1055-1081.
[44] Loboda A, Damulewicz, Pyza E, Jozkowicz A, Dulak J. Vai trò của hệ thống Nrf2 / HO-1 trong sự phát triển, phản ứng stress oxy hóa và các bệnh: một cơ chế bảo tồn tiến hóa. Tế bào Mol Life Sci. 2016; 73: 3221-3247
[ 44 ] Loboda, Damulewicz, Pyza E, Jozkowicz, Dulak J. Vai trò của Nrf2 / HO-1 hệ thống trong sự phát triển, phản ứng sức oxi hoá và bệnh : cơ chế tiết kiệm tiến hoá. Cell Mol Life Sci. 2016 ; 73 : 3221-3247.
45] Zhang H, Davies KJA, Forman HJ. Phản ứng căng thẳng oxy hóa và tín hiệu Nrf2 trong quá trình lão hóa. Medol Biol gốc tự do. 2015; 88:
CÁC NỘI DUNG KHÁC CẦN HIỂU
Mất cân bằng oxy hóa là gì?
Oxidative stress dịch sang tiếng Việt tạm hiểu là sự mất cân bằng oxi hóa, hay còn gọi là stress oxy hóa. Oxidative stress là hậu quả của sự mất cân bằng giữa sự hình thành các gốc tự do có oxy (Reactive oxygen species, viết tắt là ROS) và cơ chế kháng oxy hóa (chống lại các gốc tự do) của cơ thể (Hoạt động oxy hóa – khử trong cơ thể). Tham khảo: https://vi.wikipedia.org/wiki/Ứng_kích_ôxi_hóa
Tác hại của nó ra sao?
Bình thường, cơ thể chúng ta có cơ chế tự trung hòa các gốc tự do này. Khi bị các gốc tự do tấn công, cơ thể sẽ tiết ra ezyme để sửa chữa hoặc loại bỏ những tế bào, phân tử protein, các DNA bị hư hỏng do các gốc tự do. Tuy nhiên, nếu có quá nhiều gốc tự do tấn công cơ thể chúng ta sẽ không kịp tiết ra enzyme để khử các chất oxy hóa này. Lâu dần, cơ thể không còn cách nào để chống lại các gốc tự do nữa, dẫn đến sự mất cân bằng oxi hóa.
Sự rối loạn, mất cân bằng của trạng thái ôxi hóa khử có thể gây ra các ảnh hưởng độc hại thông qua sự sản sinh của các peroxide và gốc tự do làm hư hại tất cả các thành phần của tế bào, trong đó bao gồm protein, chất béo và DNA.
Do đó, Mất cân bằng oxy hóa (oxidative stress) là nguyên nhân gây nên nhiều bệnh lý nguy hiểm ở con người như xơ vữa động mạch, ung thư, tiểu đường, tổn thương gan, thấp khớp, đục thủy tinh thể, rối loạn thần kinh trung ương, thần kinh vận động, Parkinson, hiếm muộn, bệnh lý phụ khoa, bệnh lý trong thai kỳ…
Nguồn gốc hình thành Oxidative Stress
Oxidative stress hình thành bởi các nguyên nhân chính sau đây:
Chế độ ăn uống thiếu khoa học như tiêu thụ quá nhiều thức ăn đóng hộp, thịt đỏ, thức ăn chứa nhiều dầu mỡ, bơ, nước ngọt, rượu bia…
Tâm trạng, tinh thần lo lắng, căng thẳng, stress, buồn phiền…
Ô nhiễm môi trường: khói bụi, khí thải… hay tia UV cũng có thể tạo nên nhiều gốc tự do trong cơ thể.
Nếu các gốc tự do này không được ngăn chặn, loại bỏ kịp thời sẽ, chúng sẽ phá hủy tế bào khỏe mạnh trên diện rộng, hậu quả oxidative stress hình thành trong cơ thể chúng ta.
Glutamante là gì?
Glutamate là một chất dẫn truyền kích thích chính trong não. Mặc dù Glutamate có vai trò quan trọng trong bộ não nhưng nó cũng là chất độc hại
MỘT SỐ CÔNG BỐ KHÁC
Tác dụng trị bệnh tuyệt vời của Hydro - IZUMIO được công bố trên đài truyền hình Nhật Bản được giáo sư Shigeo Ohta thực hiện.
Nhà sinh hóa nổi tiếng thế giới Tiến sĩ Garth Nicholson tại Hội nghị Y học chống lão hoá năm 2017 (A4M) - Nước Hydrogen IZUMIO
Người dịch: Ngô Minh Yến - 0905 78 66 75





























